A noção de que o microbioma pode contribuir para a patologia de doenças do sistema nervoso central (SNC) é compartilhada por relatórios recentes [Sharon et al., 2016]. Vários estudos mostram que uma alteração nas bactérias intestinais com doenças neurodegenerativas, como a doença de Alzheimer (DA) [Mezö et al., 2020; Minter et al., 2016; Vogt et al., 2017], doença de Parkinson (PD) [Keshavarzian et al., 2015; Scheperjans et al., 2015] e outras doenças neurológicas, como esclerose múltipla [Berer et al., 2011] e distúrbios do espectro do autismo [Tabouy et al., 2018]. Microglia, os macrófagos de tecido residentes no SNC que pertencem ao sistema imunológico inato, podem vir a ser mediadores celulares entre o intestino e o cérebro. Em quase todas as doenças que afetam o cérebro, a microglia está envolvida na patogênese, embora os mecanismos moleculares que controlam a atividade e as funções da microglia sob a homeostase e no estado patológico sejam apenas parcialmente compreendidos até hoje.
Para a contribuição de treinamento
O grupo de trabalho em torno do vencedor do Prêmio Leibniz deste ano, Prof. Marco Prinz (Neuropatologia Freiburg) há muito se preocupa com a questão de saber se o microbioma intestinal influencia a microglia do sistema nervoso central. Nesse contexto, ficou claro que doenças neurodegenerativas como Parkinson ou Alzheimer podem estar diretamente relacionadas a distúrbios do microbioma intestinal. Os microrganismos encontrados na cavidade oral também parecem desempenhar um papel aqui. Esta contribuição para a formação avançada, que não trata do microbioma da cavidade oral, pretende mostrar como os futuros projectos de investigação em odontologia podem estar ligados a questões médicas gerais. Em comparação com o microbioma intestinal, os microrganismos da cavidade oral são facilmente acessíveis e, possivelmente, também mais fáceis de influenciar. Dr. Elmar Hellwig, Clínica de Odontologia e Periodontologia, Freiburg University Medical Center
Até agora, foi assumido que o cérebro é imunologicamente privilegiado devido às suas propriedades anatômicas e fisiológicas e amplamente protegido de influências externas. Em 2015, a influência até então desconhecida da microbiota do hospedeiro na maturação e função da microglia no SNC foi demonstrada [Erny et al., 2015]. Microglia de camundongos livres de germe (GF) sem bactérias intestinais mostrou uma morfologia, número de células, expressão gênica e resposta imune alterados em comparação com camundongos com bactérias intestinais. Os ácidos graxos de cadeia curta (SCFAs), que são sintetizados por bactérias intestinais durante a fermentação da fibra alimentar, foram identificados como as moléculas bacterianas responsáveis pela maturação e função da microglia [Erny et al., 2015].
No entanto, mais estudos científicos e clínicos básicos são essenciais para obter uma melhor compreensão da conexão entre as bactérias intestinais e as doenças do SNC e para desenvolver novas abordagens terapêuticas adequadas.
doença de Alzheimer
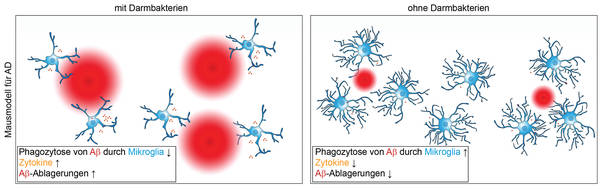
A doença de Alzheimer (DA) foi nomeada em homenagem ao psiquiatra e neuropatologista alemão Alois Alzheimer, que foi o primeiro a descrever a demência no paciente falecido Auguste Deter em 1906 [Holtzman et al., 2011]. Com 40 a 50 milhões de pessoas afetadas em todo o mundo, a DA é a doença neurodegenerativa mais comum e causa de demência, com mulheres que sofrem da doença com mais frequência do que homens [Nichols et al., 2019]. A idade é um fator de risco importante para o desenvolvimento de DA, mas fatores genéticos também desempenham um papel. A forma familiar hereditária representa apenas menos de 5% de todos os casos, e a doença geralmente ocorre bem antes dos 60 anos [Bertram e Tanzi, 2012]. Apesar da pesquisa intensiva, ainda não há opções de tratamento promissoras. Histomorfologicamente características são o acúmulo de proteína tau hiperfosforilada e a deposição extracelular de peptídeos beta-amilóides (Aβ), que são causados pela clivagem enzimática patológica da proteína precursora amilóide, APP) e se acumulam no cérebro como as chamadas placas Aβ (Figura 1) [Iqbal et al., 2005; Selkoe e Hardy, 2016]. A deposição precoce de Aβ cerebral começa décadas antes do aparecimento dos primeiros sintomas clínicos [Sperling et al., 2014] e impulsiona o desenvolvimento e a progressão da DA [Thériault et al., 2015]. Os depósitos de Aβ ativam a microglia, que tenta quebrar os depósitos de Aβ (Figura 1). Isso desencadeia uma reação imune na qual moléculas pró-inflamatórias e neurotóxicas são formadas, que no curso posterior da doença levam à perda de sinapses e degeneração dos neurônios. Como resultado, esta doença neurodegenerativa é sintomaticamente caracterizada por perda progressiva de memória e declínio nas funções cognitivas [Selkoe e Hardy, 2016]. Além dos fatores de risco genéticos, há indícios de que as bactérias intestinais também podem desempenhar um papel decisivo na progressão da DA [Harach et al., 2017; Mezö et al., 2020; Minter et al., 2016]. Estudos recentes em pacientes com DA destacaram uma correlação entre os depósitos de Aβ, citocinas pró-inflamatórias no sangue e certas bactérias intestinais em pacientes com deficiência cognitiva [Cattaneo et al., 2017]. Uma análise adicional das amostras de fezes de pacientes com DA em comparação com as de pacientes saudáveis de controle mostrou uma diversidade microbiana reduzida [Vogt et al., 2017]. No contexto de estudos em modelos de camundongos transgênicos com AD, a composição microbiana das amostras de fezes coletadas indicou uma diversidade menor em comparação com camundongos controle saudáveis, o que pode ter um impacto nos depósitos de Aβ no cérebro [Harach et al., 2017; Minter et al., 2016]. Em contraste, dois estudos atuais não puderam confirmar quaisquer mudanças robustas na diversidade microbiana [Mezö et al., 2020; Parikh et al., 2020]. A fim de ser capaz de investigar mais detalhadamente a influência da flora intestinal nos depósitos de Aβ e na progressão da DA, foram realizados estudos em camundongos Alzheimer transgênicos que foram criados em condições GF (assépticas) ou cujas bactérias intestinais foram reduzidas pela administração de antibióticos (ABX) [Harach et al., 2017; Mezö et al., 2020; Minter et al., 2016]. Ambos os camundongos AD tratados assepticamente e tratados com ABX tinham menos depósitos de Aβ do que os animais de controle transgênicos com um microbioma intestinal, tanto no estágio inicial da doença quanto no estágio avançado [Colombo et al., 2020; Harach et al., 2017; Mezö et al., 2020; Minter et al., 2016]. Como resultado, os animais com DA tratados com GF e ABX mostraram comportamento de aprendizagem aprimorado e funções de memória aprimoradas [Mezö et al., 2020]. Além disso, uma concentração reduzida de SCFA foi encontrada no plasma sanguíneo de camundongos com DA [Colombo et al., 2020]. Após a administração de SCFA, os camundongos GF-AD mostraram um aumento da deposição de Aβ, o que sugere que SCFA piora o curso da doença em modelos animais [Colombo et al., 2020]. Mas o que exatamente é responsável pela progressão mais rápida da doença de DA pelas bactérias intestinais? A microglia pode reconhecer oligômeros Aβ solúveis por meio de receptores de superfície celular, como os TLRs ("Toll-like receptor"), que levam à ativação da microglia. A microglia tenta quebrar e conter depósitos de Aβ por fagocitose (Figura 1). No entanto, a ativação sustentada da micróglia e a exposição a citocinas pró-inflamatórias neurotóxicas e quimiocinas levam à degeneração dos neurônios ao longo do tempo, o que é crucial para a progressão da doença [Heneka et al., 2015]. Foi demonstrado em camundongos GF-AD que a Microglia tem uma atividade fagocítica aumentada de Aβ e, portanto, desempenha um papel decisivo na redução dos depósitos de Aβ [Mezö et al., 2020]. Como resultado, a microglia de camundongos GF-AD mostrou uma expressão aumentada de genes que estão relacionados à fagocitose, como Trem2 (receptor de gatilho expresso em células mielóides 2), Tyrobp (proteína TYRO proteína de ligação de tirosina quinase), C1qb (componente do complemento 1q) e apoe (apolipoproteína E) [Mezö et al., 2020]. No geral, esses resultados sugerem que as bactérias intestinais têm um efeito negativo na patologia da DA, com a remoção dos depósitos de Aβ sendo prejudicada pela microglia (Figura 2). No entanto, mais estudos científicos e clínicos básicos são essenciais para compreender melhor a relação entre a microbiota e a DA e para possibilitar possíveis opções terapêuticas futuras.
Fig. 2: Influência das bactérias intestinais na microglia durante a doença de Alzheimer em um modelo animal: Microglia (azul) fagocita depósitos de Aβ (vermelho). | Mezo, Prince, Erny
Mal de Parkinson
A doença de Parkinson (DP) é um distúrbio progressivo do movimento caracterizado por rigidez, tremor, bradicinesia, mas também por sintomas não motores, como queixas intestinais e constipação crônica [O'Sullivan et al., 2008]. A nível histopatológico, a DP está associada à acumulação de agregados de α-sinucleína (α-syn), os chamados corpos de Lewy. No decurso disso, a degeneração de progressão lenta dos neurônios dopaminérgicos ocorre na substância negra do mesencéfalo [Dickson, 2018; Shulman et al., 2011]. Quase 80 por cento dos pacientes com DP têm anormalidades gastrointestinais, incluindo motilidade gástrica prejudicada, crescimento excessivo de bactérias no intestino delgado e infecções por Heliobacter pylori [Fasano et al., 2015; Scheperjans et al., 2015]. Especula-se que os agregados α-syn primeiro se acumulam na área ceco, em seguida, alcançam o cérebro através do sistema nervoso entérico através do nervo vago e, assim, se espalham “como príons” em casos esporádicos [Braak et al., 2004]. Essa suposição é apoiada pelo fato de que os agregados α-syn já estão presentes no início do intestino, nos neurônios entéricos e no nervo vago, antes mesmo de serem detectados no sistema nervoso central [Bencsik et al., 2014; Braak et al., 2004]. Além disso, foi observada uma permeabilidade intestinal anormal, que poderia promover a disseminação de α-Syn para o SNC [Forsythe et al., 2014]. Em um modelo animal, Holmqvist e colegas demonstraram que a injeção de α-Syn fibrilar no tecido intestinal de ratos saudáveis é suficiente para desencadear uma patologia no nervo vago e tronco cerebral [Holmqvist et al., 2014]. Além disso, uma vagotomia completa mostrou uma progressão moderada da doença, sugerindo o envolvimento do nervo vago como um canal para a disseminação de α-syn do sistema entérico para o SNC [Svensson et al., 2015]. Por outro lado, a estimulação elétrica do nervo vago e seu potencial efeito antiinflamatório no cérebro de camundongos que receberam lipopolissacarídeos bacterianos (LPS) para induzir uma resposta inflamatória [Meneses et al., 2016]. Consequentemente, após a estimulação elétrica, houve redução da produção de citocinas pró-inflamatórias, como a interleucina-6 (IL-6) e o fator de necrose tumoral alfa (TNFα), pela microglia no cérebro. Esta resposta não ocorreu em camundongos vagotomizados. Esses estudos apoiam a suposição de que o α-Syn entra no cérebro através do nervo vago e ativa a microglia. No entanto, a noção de que a agregação começa no sistema nervoso entérico e se espalha para o SNC permanece controversa [Burke et al., 2008], portanto, mais estudos são necessários para obter um melhor entendimento da influência das bactérias intestinais na DP. quanto à composição microbiana, análises de amostras de fezes de pacientes com DP mostraram uma composição microbiana alterada em comparação com voluntários saudáveis, que se correlacionou com o fenótipo clínico da doença [Keshavarzian et al., 2015; Scheperjans et al., 2015]. Um subgrupo de pacientes com DP apresentou aumento na incidência de Enterobacteriaceae e redução de Bacteroidetes e Prevotellaceae, que foi associada à gravidade dos sintomas motores. Unger e colegas descobriram níveis alterados de SCFA nas fezes de pacientes com Parkinson, sugerindo que os metabólitos microbianos podem desempenhar um papel na manutenção da boa saúde [Unger et al., 2016]. Este achado também foi confirmado no modelo de camundongo transgênico de Parkinson [Sampson et al., 2016]. Animais mantidos convencionalmente mostraram, juntamente com disfunção motora, um alto grau de agregação α-syn no cérebro, enquanto significativamente menos agregações α-syn e déficits motores foram observados em animais GF. A administração de SCFA intensificou drasticamente os sintomas. Conforme descrito anteriormente no contexto da DA, o acúmulo de α-Syn na DP também leva à ativação da microglia [Kim et al., 2013; Sanchez-Guajardo et al., 2013], o que leva a um aumento da expressão de TNFα e IL-6 na microglia [Sampson et al., 2016]. A ativação da microglia em camundongos PD transgênicos GF foi significativamente enfraquecida e pode ser aumentada novamente pela administração de SCFA (Figura 3). A ativação da microglia se correlacionou com a extensão dos depósitos α-syn e com o comprometimento motor correspondente.
Fig. 3: Influência das bactérias intestinais na microglia durante a doença de Parkinson em um modelo animal: Microglia (azul) são ativadas por depósitos de alfa-sinucleína (vermelho) e secretam citocinas neurotóxicas, como fator de necrose tumoral alfa (TNFα) e interleucina (IL) 6 (laranja). | Mezo, Prince, Erny
No momento, pode-se presumir que as bactérias intestinais influenciam a ativação imune dependente de α-Syn da microglia, mas a extensão em que as bactérias intestinais desencadeiam ou mesmo conduzem a patologia de DP ainda é amplamente inexplicada e está sendo investigada nos estudos atuais.
Charlotte Mezö, M.Sc.
| hospital universitário de Friburgo
desde 2017: PhD em biologia no Instituto de Neuropatologia, University Medical Center Freiburg
2014–2017: Curso de mestrado em Neurobiologia, Eberhard-Karls University of Tübingen
2011–2014: Estudo de Biologia (Bacharelado em Artes), Universidade Eberhard-Karls de Tübingen
Prof. Dr. med. Marco Prince
| hospital universitário de Friburgo
1990–1996: Estudos médicos na Universidade Humboldt em Berlim (Charitè)
1997: Dissertação em medicina humana, Humboldt University Berlin (Charitè)
1997–1998: Pós-doutorado, Neurociência Celular, Centro Max Delbrück (MDC), Berlim
1999–2000: Pós-doutorado, Instituto de Neuropatologia, Hospital Universitário de Zurique
2001–2002: Pós-doutorado Sênior, Instituto de Neuropatologia, Hospital Universitário de Zurique
2002–2008: Líder do grupo e, desde 2004, médico sênior, Instituto de Neuropatologia, Georg-August University, Göttingen
2004: Habilitação em neuropatologia, Georg August University, Göttingen
desde 2008: Diretor Médico (W3), Instituto de Neuropatologia, Hospital Universitário de Freiburg
Prinz foi o coordenador de grandes projetos científicos e conferências, por exemplo na DFG-SFB / TR1667 "NeuroMac" (porta-voz), grupo de pesquisa DFG FOR 1336 "Brain macrophages" (co-porta-voz), conferência Keystone "Microglia", Keystone, EUA (organizador). Ele trabalha como revisor para revistas especializadas como Cell, Immunity, Nature, Nat Neurosci, Science.