Hintergrund:
Die Hyperphosphatämie konnte in den vergangenen zehn Jahren bei fortgeschrittener Niereninsuffizienz als einer der aussagekräftigsten Prädiktoren der Mortalität identifiziert werden. In diesem Kollektiv (Stadium CKD 5) wurden beispielsweise bei einer Jahresmortalität von rund einem Fünftel nicht weniger als 12 % der Todesfälle auf das Vorliegen von erhöhtem Serumphosphat zurückgeführt. Kürzlich wurde auch für die Normalbevölkerung dokumentiert, dass sich bereits anhand hochnormaler Phosphatkonzentrationen im Serum ein Sterbe-/Mortalitätsrisiko unabhängig voraussagen lässt. In diesem Zusammenhang spielen Phosphatzusätze in Lebensmitteln eine potenziell entscheidende Rolle, sie werden jedoch in ihrer Bedeutung für die Gesundheit vermutlich unterschätzt.
Methode:
Die Autoren führten eine selektive Literaturrecherche in der Datenbank PubMed und EU-Datenbanken (www.zusatzstoffe-online.de, www.codexalimentarius.de) durch, mit den Suchbegriffen „phosphate additives“ und „hyperphosphatemia“.
Ergebnisse:
Die natürliche Phosphatzufuhr in Form von organischen Estern muss nicht wesentlich reduziert werden, da dieses Phosphat nur teilweise resorbiert wird und seine eingeschränkte Aufnahme zu einer Eiweißunterernährung führen könnte. Freies Phosphat als Nahrungsmittelzusatzstoff wird hingegen effektiv resorbiert und bedingt eine deutlich messbare Erhöhung der Phosphatserumspiegel bei Patienten mit fortgeschrittener Niereninsuffizienz. Nahrungsmittel mit Phosphatzusätzen werden vor allem in sozial schwächeren Bevölkerungsschichten konsumiert (vermehrter Verzehr von Fast Food). Pathophysiologisch bewirkt Phosphat in erster Linie Gefäßschäden wie beispielsweise eine endotheliale Dysfunktion und Kalzifikationen. Unabhängig von der zu beachtenden Phosphatqualität sollte die tägliche Phosphatzufuhr bei Patienten mit fortgeschrittener Niereninsuffizienz gemäß Leitlinien 1 000 mg pro Tag nicht überschreiten.
Schlussfolgerung:
Obwohl für die Allgemeinbevölkerung noch keine prospektiv kontrollierten Studien vorliegen, sollte einerseits schon allein angesichts der Häufigkeit chronischer Nierenerkrankungen und andererseits aufgrund der potenziellen Schädlichkeit einer hohen Phosphatzufuhr auch für Nierengesunde, der Phosphatgehalt von Nahrungsmitteln gekennzeichnet werden. Zudem sollten die Bevölkerung und die Ärzteschaft über die Rolle der Phosphatzusätze als Risikofaktor aufgeklärt werden.
Die Phosphatzufuhr über Nahrungsmittel und die Höhe der Konzentration von Serumphosphat sind nicht nur für Nierenkranke bedeutsam. In neuerer Zeit hat sich gezeigt, dass Phosphatzusätze in Nahrungsmitteln auch für die Normalbevölkerung potenziell nachteilige gesundheitliche Auswirkungen haben können (1, e1). Diese Einsicht stützt sich insbesondere auf große epidemiologische Studien und wird unterstützt durch Fortschritte der Grundlagenforschung.
Zuerst wurde bei Patienten mit Nierenkrankheiten erkannt, dass hohe Serumphosphatspiegel einer der potentesten Risikofaktoren für eine erhöhte Gesamt- und kardiovaskuläre Mortalität sind (2, 3). In der Studie von Block et al. wurde nach multivariabler Adjustierung errechnet, dass 12 % der beobachteten 10 015 Todesfälle in der Kohorte von 40 538 prävalenten Hämodialysepatienten im Beobachtungszeitraum Hyperphosphatämie-assoziiert waren (2). Bei Patienten mit chronischer Niereninsuffizienz wird daher seit Jahrzehnten bereits eine diätetische Phosphatrestriktion empfohlen (4). Dieses Konzept wird unterstützt durch die Ergebnisse einer prospektiven Beobachtungsstudie über fünf Jahre an chronischen Hämodialysepatienten, die zeigte, dass eine niedrigere diätetische Phosphatzufuhr mit einem signifikanten Überlebensvorteil assoziiert ist. Im Vergleich der Tertilen mit der höchsten gegenüber der niedrigsten Phosphatzufuhr war das Versterberisiko um das 2,37-fache erhöht (5). Eine Aufklärung über phosphathaltige Lebensmittelzusatzstoffe und deren Vorkommen in Nahrungsmitteln führte in einer kontrollierten Interventionsstudie zur Vermeidung von Nahrungsmitteln mit Phosphatzusätzen und gleichzeitig zur Absenkung der Serumphosphatspiegel .
Neuere Untersuchungen zeigen ferner, dass der Zusammenhang zwischen hohen Serumphosphatspiegeln und Überleben nicht nur auf Nierenkranke beschränkt ist, sondern auch bei Patienten mit kardiovaskulären Erkrankungen und selbst in der Allgemeinbevölkerung gefunden wird. Bereits hochnormale Serumphosphatspiegel sind bei jungen gesunden Männern mit dem Auftreten von Koronarverkalkungen vergesellschaftet (6), und hochnormale Serumphosphatspiegel waren in der Framingham-Studie ein Prädiktor kardiovaskulärer Ereignisse (7). Eine erhöhte Mortalität wurde vor allem bei nierengesunden kardial erkrankten Patienten mit Serumphosphatspiegeln im oberen Normbereich gesehen (8)
(Grafik 1)
. In dieser Studie gab es bei 4 127 Teilnehmern 375 Todesfälle innerhalb von 60 Monaten, wobei das adjustierte Mortalitätsrisiko pro 1 mg/dL höherem Serumphosphat 22 % betrug.
Grafik 1
Perzentilen der diätetischen Phosphatzufuhr und Gesamtmortalität bei 224 Patienten mit Hämodialyse und Verlaufsbeobachtung bis zu 5 Jahren; Hazard Ratio nach voller Adjustierung war in der höchsten im Vergleich zur niedersten Perzentile 2,37.
Bild vergrößernAlle Bilder
Das Problem eines mit Serumphosphat assoziierten Überlebensrisikos geht also nicht nur den Nephrologen etwas an, auch wenn diese Beobachtungsstudien eine unmittelbare Ursache-Wirkungs-Beziehung noch nicht zweifelsfrei belegen. Aus diesem Grund wurde für diese Übersicht eine selektive Literatursuche durchgeführt, die gezielt auf die Datenbank PubMed und EU-Datenbanken (www.zusatzstoffe-online.de, www.codexalimentarius.de) fokussierte. Die Autoren haben durch Mitarbeit in internationalen Leitlinienarbeitsgruppen („Kidney Disease – Improving Global Outcomes“ [KDIGO] Initiative [MK]) (4) und bei der Entwicklung von Ernährungsprogrammen für Dialysepatienten („Phosphat-Einheiten-Programm“ [PEP] [MKK]) bereits frühzeitig Einblicke in diese noch junge Literatur erhalten, so dass die relevanten Publikationen entsprechend fundiert identifiziert werden konnten. Bei der Recherche wurde allerdings auch klar, dass prospektive kontrollierte Studien zu diesem Themengebiet nur unzureichend zur Verfügung stehen.
Hauptquellen leicht resorbierbaren Phosphats
Natürlich vorkommend findet man Phosphat in Form organischer Ester in zahlreichen Lebensmitteln, wie Fleisch, Kartoffel-, Brot- und Mehlprodukten, deren Konsum nicht ohne das Risiko einer verminderten Eiweißzufuhr eingeschränkt werden kann. Dieses organisch gebundene Phosphat wird nur zu 40–60 % intestinal absorbiert (e1).
Ein vermeidbares Gesundheitsproblem von bislang unterschätztem Ausmaß verbirgt sich hingegen hinter der verbreiteten Verwendung von Phosphat als Nahrungsmittelzusatzstoff beziehungsweise als Konservierungsmittel. Dieses „freie“, nicht organisch gebundene Phosphat wird intestinal sehr effektiv absorbiert. Klassische Beispiele für Nahrungsmittel mit hohen Phosphatzusätzen sind zum Beispiel bearbeitetes Fleisch („processed meat“), Schinken, Wurst, Fischkonserven, Backwaren, Cola-Getränke und andere Softdrinks. Ein wichtiges Problem, das die diätetische Führung der Patienten erschwert, besteht darin, dass der Phosphatgehalt, und speziell der Phosphatzusatz, in Nahrungsmitteln nicht gekennzeichnet ist.
In der Vergangenheit wurde vermutet, dass Phosphat lediglich dadurch gesundheitlich nachteilig ist, dass es zu Verkalkung von Gefäßen und Organen führt. Neuere Einsichten in die hormonale Regulation des Phosphatstoffwechsels belegen, dass die erst vor kurzem nachgewiesenen Faktoren Fibroblast Growth Factor-23 (FGF23) und Klotho die Serumphosphat-Konzentration kontrollieren, dass Phosphat direkt oder über diese hormonalen Faktoren mit nachhaltigen Schädigungen kardiovaskulärer Organe assoziiert ist und im Tierversuch sogar Alterungsvorgänge beschleunigt (e2, e3).
Insbesondere Phosphatzusätze im Tierfutter, wie sie aber auch in Nahrungsmitteln für den Menschen zu finden sind, beschleunigen im Tierexperiment und wahrscheinlich auch beim Menschen das Auftreten altersbedingter Organkomplikationen wie Muskel- und Hautatrophie, das Fortschreiten chronischer Niereninsuffizienz und kardiovaskuläre Verkalkungen (e2). Da billige Nahrungsmittel mit Zusatzstoffen („processed food”) und insbesondere „fast food“ außerordentlich reich an Phosphatzusätzen sind, wird zum Beispiel in den USA in sozial schwächeren Schichten eine Hyperphosphatämie doppelt so häufig beobachtet wie in Bevölkerungsgruppen mit höherem Einkommen. In der US-amerikanischen „Chronic Renal Insufficiency Cohort“ (CRIC)-Studie, die Patienten mit mild bis mäßiggradig eingeschränkter Nierenfunktion longitudinal untersucht, war das multivariable adjustierte Risiko einer Hyperphosphatämie (> 1,45 mmol/L) um das 2,5- bis 2,7-fache erhöht, wenn die Tertilen der niedrigsten und der höchsten Einkommensschicht miteinander verglichen wurden (9). Diese Beobachtung wurde bei insgesamt etwa gleich hoher täglicher Phosphatzufuhr (1 156 versus 1 190 mg/Tag) gemacht, so dass dieser Befund auf die unterschiedliche Phosphatqualität in den Nahrungsmitteln zurückzuführen ist. Es ist das Ziel der vorliegenden Mitteilung, Kollegen, die mit diesen neuen Gesichtspunkten nicht vertraut sind, zu informieren und darüber hinausgehend die gesundheitspolitisch interessierte Öffentlichkeit auf das Problem überhöhter Phosphatzufuhr aufmerksam zu machen.
Hormonale Phosphatregulation
Bis vor kurzem wurde im Medizinstudium gelehrt, dass Phosphat im Darm proportional zur aufgenommenen Nahrung absorbiert und die aufgenommene Menge über die Nieren problemlos wieder ausgeschieden wird. Üblicherweise wird bis zu 80 % des mit der Nahrung aufgenommenen Phosphats im Darm resorbiert, wobei die Transportrate je nach Phosphatquelle (und Vitamin-D-Status) differiert. Rund zwei Drittel des aufgenommenen Phosphats wird renal, ein Drittel fäkal eliminiert (10). Erst in den letzten fünf Jahren wurde realisiert, dass Phosphathaushalt und renale Phosphatausscheidung durch ein komplexes endokrines Feedback-System reguliert werden. Das Schlüsselhormon zur Kontrolle des Phosphathaushalts ist FGF23 (11, e4). In genetisch manipulierten Mäusen führt der Verlust dieses Hormons zu schwerer Hyperphosphatämie und parallel durch vermehrte 1-alpha-Hydroxylierung zur Steigerung der renalen Calcitriolsynthese (12). Umgekehrt steigert erhöhtes FGF23 die Phosphatausscheidung über die Niere und vermindert die Aktivierung von Vitamin D zu Calcitriol.
Zwei Hormonsysteme verhindern die Phosphatakkumulation
FGF23 wird überwiegend in den Osteozyten des Knochens gebildet (10, 11, e4). Die Sekretion von FGF23 wird durch eine hohe intestinale Phosphatresorption beziehungsweise erhöhte Serumphosphatspiegel gesteigert, wobei noch nicht klar ist, ob diese Stimulation direkt oder über bislang noch nicht identifizierte intestinale Botenmoleküle verursacht wird (10). Die durch FGF23-bedingte Steigerung der Phosphaturie kann selbst bei progredienter Niereninsuffizienz für lange Zeit die Entwicklung einer Hyperphosphatämie verhindern – eindeutig erhöhte Serumphosphatwerte werden erst unterhalb einer glomerulären Filtrationsrate (GFR) von 30 mL/min (Stadium CKD 4) gefunden. Der Preis für die Normophosphatämie in Frühstadien der Niereninsuffizienz sind progredient steigende FGF23- und Parathormon (PTH)-Spiegel: FGF23 steigert indirekt durch Suppression der renalen Calcitriolsynthese die Sekretion von Parathormon (sekundärer Hyperparathyreoidismus). PTH wirkt neben FGF23 ebenfalls phosphaturisch. Der Organismus setzt also zwei potente Hormonsysteme (FGF23, PTH) ein, um bei progressivem Nierenfunktionsverlust eine Hyperphosphatämie möglichst lange zu verhindern (13, e5).
FGF23 wirkt nur an Niere und Parathyreoidea, also an Organen, die Klotho exprimieren. Klotho ist eine membranständige β-Glukuronidase, die als FGF23-Korezeptor fungiert (10, 11, e4). Wenn Klotho fehlt, entstehen dieselben Veränderungen wie bei komplettem FGF23-Mangel, das heißt Hyperphosphatämie und Erhöhung der Konzentration von aktivem Vitamin D. Außerdem entwickeln Klotho-Knockout-Mäuse – ebenso wie die FGF23-defizienten Mäuse – einen Phänotyp, der vorzeitiges Altern imitiert, das heißt Gefäßverkalkung, Osteoporose, Hautatrophie, Lungenemphysem, Infertilität und frühzeitige Mortalität (14).
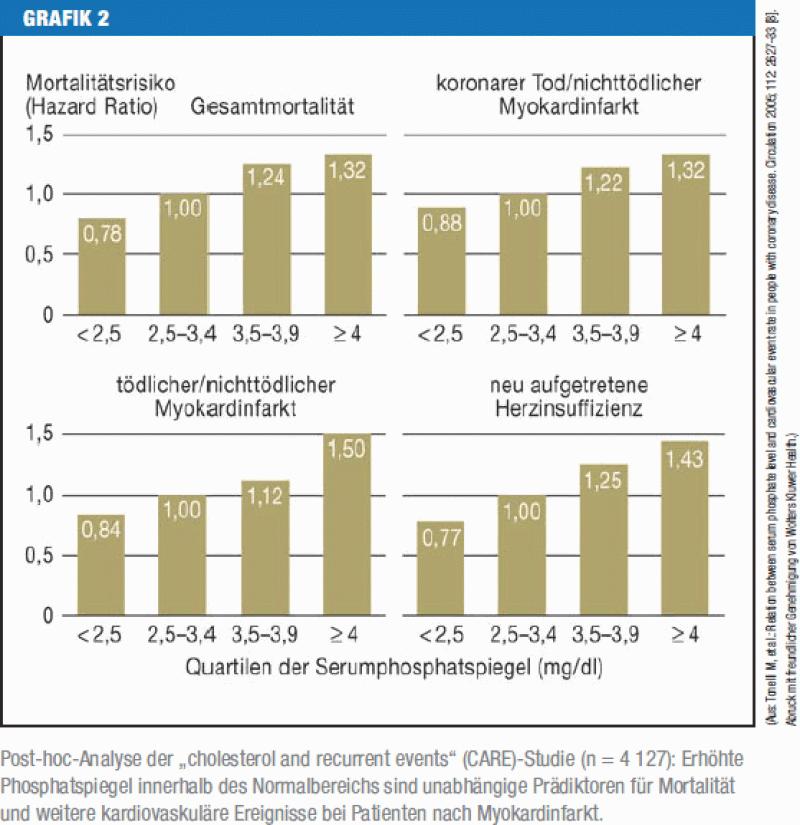
Aus dem oben Gesagten ergibt sich, dass bereits hochnormale Phosphatspiegel bei Nierengesunden und vor allem bei Patienten mit kardiovaskulären Erkrankungen mit erhöhter Morbidität und Mortalität assoziiert sind (6, 7)
(Grafik 2)
.
Grafik 2
Post-hoc-Analyse der „cholesterol and recurrent events“ (CARE)-Studie (n = 4 127): ErhöhtePhosphatspiegel innerhalb des Normalbereichs sind unabhängige Prädiktoren für Mortalitätund weitere kardiovaskuläre Ereignisse bei Patienten nach Myokardinfarkt.
Bild vergrößernAlle Bilder
Kuro-o, der Erstbeschreiber des Klotho/FGF23 Systems, betrachtet daher Serumphosphat als Surrogatmarker, der den Grad der Intaktheit der endokrinen Phosphat/FGF23/Klotho-Achse widerspiegelt. Niedere Aktivität von Klotho geht mit hoher Konzentration von Serumphosphat einher. Kuro-o bezeichnet daher Phosphat als das „Signalmolekül des Alterns“, wobei diese Interpretation bislang weitgehend auf tierexperimentellen Daten beruht (15).
Phosphat und die Blutgefäße
Phosphat induziert Gefäßverkalkungen in vitro und in vivo (16, e6). Dabei handelt es sich in erster Linie nicht um eine passive Präzipitation von Calcium × Phosphat, sondern um einen aktiven zellulären Prozess, wobei Gefäßmuskelzellen in Osteoblasten-ähnliche Zellen umprogrammiert werden (sogenannte osteogene Transdifferenzierung) (16). Dieser in Zellkulturen und Tierexperimenten ursprünglich identifizierte Prozess konnte auch in Arterien beim Menschen nachgewiesen werden (17, e7). Neuerdings konnte zudem gezeigt werden, dass eine erhöhte Phosphatzufuhr sowohl experimentell als auch klinisch zu einer deutlichen Beeinträchtigung der Endothelfunktionen im Gefäßsystem führt (18). Die Phosphat-induzierte Gefäßpathologie stellt potenziell die Verbindung zu Alterungsprozessen und Mortalität dar.
Risiken durch Hypophosphatämie
Schließlich bleibt zu erwähnen, dass die sehr seltenen genetischen oder tumorassoziierten Störungen des Klotho/FGF23-Systems zu schwerer Hypophosphatämie führen, die im Kindesalter in einer hypophosphatämische Rachitis und im Erwachsenenalter in einer Osteomalazie münden können (10, 11, e4). Ansonsten wird eine klinisch relevante Hypophosphatämie nur bei extremer Malnutrition beobachtet, zum Beispiel allenfalls bei Patienten mit Sepsis auf der Intensivstation bei Phosphatkonzentrationen von circa < 0,5 mmol/L, was in Einzelfällen zu Rhabdomyolyse durch depletierte Energiespeicher (intrazellulärer ATP-Mangel) führt.
Phosphat als Lebensmittelzusatzstoff
Wie bereits dargestellt, findet man organische Phosphatester hauptsächlich in eiweißreichen Lebensmitteln wie Milchprodukten, Fisch, Fleisch- und Wurstwaren sowie Eiern. Sie werden im Gastrointestinaltrakt langsam hydrolysiert und anschließend zu 40–60 % langsam gastrointestinal absorbiert (e1, e8).
Die in Getreide, Nüssen und Hülsenfrüchten enthaltenen Phosphate liegen vorwiegend in Form von Phytinsäure (Hexa-Phospho-Inosit) vor, das im menschlichen Darm aufgrund des fehlenden Enzyms Phytase nicht gespalten werden kann (19). Die Bioverfügbarkeit pflanzlicher Phosphatester liegt in der Regel unter 50 % (8, 20) und somit deutlich niedriger als die der Phosphatester eiweißreicher Lebensmittel. Folglich ist der Phosphatgehalt der Nahrung nicht automatisch mit der Phosphatbeladung gleichzusetzen.
Der Phosphatgehalt industriell verarbeiteter Nahrungsmittel ist wesentlich höher als in natürlichen Lebensmitteln, da Polyphosphate in der industriellen Nahrungsmittelherstellung vielfach als Lebensmittelzusatzstoff eingesetzt werden
(Tabelle)
.
Tabelle
Phosphorgehalt verschiedener Lebensmittelgruppen
Bild vergrößernAlle Bilder
Nach Europäischer Gesetzgebung dürfen Natriumphosphat (E 339), Kaliumphosphat (E 340), Calciumphosphat (E 341) und Salze der ortho-Phosphorsäure Diphosphat (E 450), Triphosphat (E 451) sowie Polyphosphat (E 452) eingesetzt werden als Konservierungsmittel, Säuerungsmittel, Säureregulatoren und Emulgatoren. Vielen Lebensmitteln werden heute Phosphatsalze auch als Stabilisatoren oder Geschmacksverstärker zugesetzt.
In erster Linie tragen heute „fast food“- und Fertigprodukte zu dem gegenwärtig steigenden Phosphatkonsum bei. Aufgrund des gesteigerten Einsatzes von Lebensmittelzusatzstoffen hat sich die geschätzte tägliche Zufuhr an phosphathaltigen Lebensmittelzusatzstoffen seit den 1990er Jahren von knapp 500 mg/Tag auf 1 000 mg/Tag mehr als verdoppelt (21, e9). Diese Größenordnung konnte in einer rezenten Untersuchung bestätigt werden: In prozessierten Fleisch- und Geflügelprodukten war der Phosphatgehalt durch den Phosphatzusatz im Vergleich zum natürlichen Produkt annähernd verdoppelt (22). Dies hat Auswirkungen für die Verordnung phosphatreduzierter Diäten für Patienten mit eingeschränkter Nierenfunktion, wegen der genannten Zusammenhänge mittelbar jedoch auch für kardiovaskulär erkrankte Patienten und die Allgemeinbevölkerung.
Eine besonders bedeutende Rolle spielen Phosphat-zusätze in der Fleischindustrie, wo sie als Konservierungsmittel eingesetzt werden. Eine weitere Rolle spielen sie als Komponente des Schmelzsalzes bei der Schmelzkäseherstellung. Phosphate lockern die Struktur von Eiweißen und versetzen diese in die Lage, (mehr) Wasser zu binden. Zugesetzte Phosphate findet man in größeren Mengen auch in nichtalkoholischen, aromatisierten Getränken, sterilisierter, ultrahocherhitzter sowie eingedickter Milch und Milchpulver. Ein weiterer Grund für die Verwendung von Phosphaten ist die Verhinderung des Zusammenklumpens rieselfähiger Lebensmittel wie Kaffee- und Puddingpulver. Cola-Getränken und aromatisierten Erfrischungsgetränken sind oft größere Mengen an Phosphorsäure (E 338) als Säuerungsmittel zugesetzt. Säuerungsmittel werden eingesetzt, um den pH-Wert von Lebensmitteln zu erniedrigen und auf diese Weise das Wachstum von Hefen, Pilzen und Bakterien zu hemmen.
Ohne Phosphatzusatz wären Cola-Getränke pechschwarz
Der Phosphatzusatz in Cola-Getränken ist besonders bemerkenswert, da Phosphat hier eine Glykierungsreaktion (AGE, „advanced glycation end products“) unterbricht, die ungebremst dazu führen würde, dass dieses Getränk sich pechschwarz färbt – die dunkelbraune Cola-Farbe ist also „phosphatbedingt“. Nach europäischer Rahmenrichtlinie darf der Phosphatgehalt von Cola-Getränken bis zu 700 mg/L betragen; insofern entspricht ein Liter bereits 50–75 % der empfohlenen Tageszufuhr an Phosphat für Erwachsene. De facto werden Cola-Getränken circa 520 mg Phosphatzusatz pro Liter zu hinzugefügt.
In Europa sind mehr als 300 Lebensmittelzusatzstoffe zugelassen und anhand einheitlicher E-Nummern gekennzeichnet. Gemäß EU-Richtlinie müssen auf verpackten Lebensmitteln alle Zusatzstoffe durch E-Nummern gekennzeichnet sein. Für Bio-Lebensmittel schränkt die EG-Öko-Verordnung die Verwendung von Lebensmittelzusatzstoffen deutlich ein; aus der Gruppe der phosphathaltigen Zusatzstoffe ist bei Bio-Lebensmitteln allein Calciumphosphat zugelassen. Die Kennzeichnungspflicht ist nur qualitativ und leider nicht quantitativ. Der Konsument oder Patient kann daher nicht entscheiden, wie viel Phosphat in Lebensmitteln enthalten ist, da weder die Gesamtmenge, noch die zugesetzte Menge an Phosphat angegeben werden.
Handlungsbedarf
Vor dem Hintergrund des bei niereninsuffizienten Patienten bekannten Zusammenhangs zwischen Nahrungsphosphat und Organverkalkung sowie der zunehmenden Erkenntnis, dass Phosphat selbst bei nierengesunden Menschen zu einer gesundheitlichen Belastung führen kann, stellt sich die Frage, ob hier gesundheitspolitisch eingegriffen werden sollte – wenngleich bislang noch keine Ergebnisse prospektiver Interventionsstudien vorliegen.
Aufklärung der Bevölkerung und Kennzeichnung der Nahrungsmittel
Ein wichtiges Standbein wäre die umfassende Aufklärung der Ärzteschaft und der Öffentlichkeit über den potenziellen Einfluss von Phosphat auf das kardiovaskuläre und renale Risiko. Das erhöhte kardiovaskuläre Risiko durch Phosphat, das bei dialysepflichtigen Patienten bereits lange bekannt ist, betrifft nach heutigem Wissensstand aber auch die stetig wachsende Zahl von Menschen mit nur mäßiggradig eingeschränkter und sogar normaler Nierenfunktion (6, 7, 23). Damit gewinnt das Problem phosphatinduzierter Organschädigung auch durch den Wandel der Altersstruktur unserer Gesellschaft eine zunehmende gesundheitspolitische Dimension. Dies wird noch aggraviert durch die Häufung von Zivilisationskrankheiten wie Diabetes mellitus, Hypertonie und koronarer Herzkrankheit, die ebenfalls Nierenschäden verursachen und den altersbedingten Nierenfunktionsverlust beschleunigen. Zusammenhänge zwischen Phosphat und Progression einer Niereninsuffizienz waren bereits in den frühen Achtzigerjahren vermutet und untersucht worden (24, e10).
Empfehlenswert im Sinne einer Sensibilisierung der Bevölkerung für die Phosphatproblematik und das daraus resultierende Gesundheitsrisiko sind mediengestützte Informationen zum Thema, wobei auf eine laiengerechte Darstellung der Thematik unter Beibehaltung wissenschaftlich korrekter Aussagen zu achten ist.
Kennzeichnung des Phosphatgehalts
Wünschenswert ist darüber hinaus eine allumfassende Kennzeichnung der Phosphatzusätze – idealerweise nach dem Ampelprinzip – sowie eine Mengenbegrenzung der Phosphatzusätze. Analog der Kennzeichnung des Kochsalzgehaltes, wie sie bereits in Finnland und Großbritannien praktiziert wird, sollte anhand der Farben „grün-gelb-rot“ die zu erwartende Zufuhr von zugesetztem Phosphat graduell kenntlich gemacht werden. Hier sollte sowohl die Unterstützung der Nahrungsmittelindustrie als auch der Verbraucherschutzorganisationen, medizinischen Gesellschaften und anderen Körperschaften (Krankenkassen, Bundesgesundheitsministerium, Europäische Union) gesucht werden, um diese Maßnahmen konsequent umsetzen zu können. Dank guter wissenschaftlicher Abklärung der Zusammenhänge und Aufklärungsarbeit medizinischer Institutionen ist die Öffentlichkeit beispielsweise derzeit gut informiert über die gesundheitlichen Folgen des hohen Salzkonsums (25).
Abzuklären ist auch die Frage, ob die Assoziation zwischen Morbidität beziehungsweise Mortalität und Serumphosphat-Konzentration eine direkte Folge der „Phosphattoxizität“ ist, oder das Resultat pathologischer Konzentration der Phosphat-regulierenden Hormone FGF23/Klotho. Phosphat könnte somit zusätzlich ein Surrogatparameter dieses Hormonsystems sein. Die Autoren der vorliegenden Übersicht glauben, dass umfassende Informationen und eine wissenschaftlich fundierte Darstellung der gesundheitsrelevanten Problematik einer erhöhten Phosphatzufuhr sowie die transparente Kennzeichnung des Phosphatgehaltes von Nahrungsmitteln helfen können, diesen neuen kardiovaskulären Risikofaktor zu entschärfen.
Interessenkonflikt
Prof. Ritz bekam Honorare für Beratertätigkeiten von den Firmen Daiichi Sankyo, Abbott, Mitsubishi Tanabe, Rofar, Medice und Hexal.
Dr. Hahn wurde honoriert für Beratertätigkeiten und Vorträge und erhielt Reisekosten- und Fortbildungsgebührenerstattung von den Firmen Genzyme, Shire und Medice.
Prof. Ketteler erhielt Honorare für Beratertätigkeiten und Vorträge von den Firmen FMC, Genzyme und Shire.
Prof. Kuhlmann wurde für Beratertätigkeiten honoriert von den Firmen Sanofi-Aventis, Roche, Fresenius. Er bekam Vortragshonorare von den Firmen Shire, Amgen, Roche, Fresenius, Braun, Genzyme.
Prof. Mann erklärt, dass kein Interessenkonflikt besteht.
Manuskript
eingereicht: 8. 12. 2010, revidierte Fassung angenommen: 15. 6. 2011
Anschrift für die Verfasser
Prof. Dr. med. Eberhard Ritz
Nierenzentrum Heidelberg
Im Neuenheimer Feld 162
69120 Heidelberg
prof.e.ritz@t-online.de; bueroritz@gmx.de
Summary
Phosphate Additives in Food—a Health Risk
Background:
Hyperphosphatemia was identified in the past decade as a strong predictor of mortality in advanced chronic kidney disease (CKD). For example, a study of patients in stage CKD 5 (with an annual mortality of about 20%) revealed that 12% of all deaths in this group were attributable to an elevated serum phosphate concentration.
Recently a high-normal serum phosphate concentration has also been found to be an independent predictor of cardiovascular events and mortality in the general population. Therefore, phosphate additives in food are a matter of concern and their potential impact on health may well have been underappreciated.
Methods:
We reviewed pertinent literature retrieved by a selective search of the PubMed and EU databases (www.zusatzstoffe-online.de, www.codexalimentarius.de), with the search terms “phosphate additives” and “hyperphosphatemia.”
Results:
There is no need to reduce in the food the content of natural phosphate, i.e. organic esters, because this type of phosphate is incompletely absorbed; restricting its intake might even lead to protein malnutrition. On the other hand, inorganic phosphate as food additives are effectively absorbed and can measurably elevate the serum phosphate concentration in patients with advanced CKD. Foods with added phosphate tend to be eaten by persons at the lower end of the socioeconomic scale, who consume more processed and „fast“ food. The main pathophysiological consequence of phosphate is vascular damage, e.g. endothelial dysfunction and vascular calcification. Aside from the quality of phosphate in the diet (which also requires attention), the quantity of phosphate consumed by patients with advanced renal failure should not exceed 1000 mg per day, according to the guidelines.
Conclusion:
Prospective controlled trials are currently not available. In view of the high prevalence of CKD and the potential harm conveyed by phosphate additives to food, the population should be educated that added phosphate is damaging to health. Furthermore, calls for labeling the content of added phosphate in food are appropriate.
Zitierweise
Ritz E, Hahn K, Ketteler M, Kuhlmann MK, Mann J: Phosphate additives in food—a health risk. Dtsch Arztebl Int 2012; 109(4): 49–55.
DOI: 10.3238/arztebl.2012.0049
@Mit „e“ gekennzeichnete Literatur:www.aerzteblatt.de/lit0412
The English version of this article is available online:www.aerzteblatt-international.de
1.
Sullivan C, et al.: Effect of food additives on hyperphosphatemia among patients with end-stage renal disease: a randomized controlled trial. JAMA 2009; 301: 629–35. CrossRef MEDLINE
2.
Block GA, et al.: Mineral metabolism, mortality, and morbidity in maintenance hemodialysis. JASN 2004; 15: 2208–18. CrossRef MEDLINE
3.
Kestenbaum B, et al.: Serum phosphate levels and mortality risk among people with chronic kidney disease. JASN 2005; 16: 520–8. CrossRef MEDLINE
4.
KDIGO clinical practice guideline for the diagnosis, evaluation, prevention, and treatment of Chronic Kidney Disease-Mineral and Bone Disorder (CKD-MBD). Kidney Int Suppl 2009: S1–130. MEDLINE
5.
Noori N, et al.: Association of dietary phosphorus intake and phosphorus to protein ratio with mortality in hemodialysis patients. CJASN 2010; 5: 683–92. MEDLINE
6.
Foley RN, et al.: Serum phosphorus levels associate with coronary atherosclerosis in young adults. JASN 2009; 20: 397–404. CrossRef MEDLINE
7.
Dhingra R, et al.: Relations of serum phosphorus and calcium levels to the incidence of cardiovascular disease in the community. Arch Intern Med 2007; 167: 879–85. CrossRef MEDLINE
8.
Tonelli M, et al.: Relation between serum phosphate level and cardiovascular event rate in people with coronary disease. Circulation 2005; 112: 2627–33. CrossRef MEDLINE
9.
Gutierrez OM, et al.: Low socioeconomic status associates with higher serum phosphate irrespective of race. JASN 2010; 21: 1953–60. CrossRef MEDLINE
10.
Berndt T, Kumar R: Novel mechanisms in the regulation of phosphorus homeostasis. Physiology (Bethesda) 2009; 24: 17–25. CrossRef MEDLINE
11.
Liu S, Quarles LD: How fibroblast growth factor 23 works. JASN 2007; 18: 1637–47. CrossRef MEDLINE
12.
Shimada T, et al.: Targeted ablation of Fgf23 demonstrates an essential physiological role of FGF23 in phosphate and vitamin D metabolism. J Clin Invest 2004; 113: 561–8. MEDLINE
13.
Wetmore JB, Quarles LD: Calcimimetics or vitamin D analogs for suppressing parathyroid hormone in end-stage renal disease: time for a paradigm shift? Nat Clin Pract Nephrol 2009; 5: 24–33. CrossRef MEDLINE
14.
Kuro-o M, et al.: Mutation of the mouse klotho gene leads to a syndrome resembling ageing. Nature 1997; 390: 45–51. CrossRef MEDLINE
15.
Kuro-o M: A potential link between phosphate and aging—lessons from Klotho-deficient mice. Mech Ageing Dev 2010; 131: 270–5. CrossRef MEDLINE
16.
Giachelli CM: The emerging role of phosphate in vascular calcification. Kidney Int 2009; 75: 890–7. CrossRef MEDLINE
17.
Shroff RC, et al.: Chronic mineral dysregulation promotes vascular smooth muscle cell adaptation and extracellular matrix calcification. JASN 2010; 21: 103–12. CrossRef MEDLINE
18.
Shuto E, et al.: Dietary phosphorus acutely impairs endothelial function. JASN 2009; 20: 1504–12. CrossRef MEDLINE
19.
Bohn L, Meyer AS, Rasmussen SK: Phytate: impact on environment and human nutrition. A challenge for molecular breeding. J Zhejiang Univ Sci B 2008; 9: 165–91. CrossRef MEDLINE
20.
Lei XG, Porres JM: Phytase enzymology, applications, and biotechnology. Biotechnol Lett 2003; 25: 1787–94. CrossRef MEDLINE
21.
Kalantar-Zadeh K, et al.: Understanding sources of dietary phosphorus in the treatment of patients with chronic kidney disease. CJASN 2010; 5: 519–30. MEDLINE
22.
Sherman RA, Mehta O: Phosphorus and potassium content of enhanced meat and poultry products: implications for patients who receive dialysis. CJASN 2009; 4: 1370–3. MEDLINE
23.
Tonelli M, Pannu N, Manns B: Oral phosphate binders in patients with kidney failure. NEJM 2010; 362: 1312–24. CrossRef MEDLINE
24.
Haut LL, et al.: Renal toxicity of phosphate in rats. Kidney Int 1980; 17: 722–31. CrossRef MEDLINE
25.
Klaus D, Hoyer J, Middeke M: Salt restriction for the prevention of cardiovascular disease. Dtsch Arztebl Int 2010; 107(26): 457–62. VOLLTEXT
e1.
Uribarri J: Phosphorus homeostasis in normal health and in chronic kidney disease patients with special emphasis on dietary phosphorus intake. Semin Dial 2007; 20: 295–301. CrossRef MEDLINE
e2.
Ohnishi M, Razzaque MS: Dietary and genetic evidence for phosphate toxicity accelerating mammalian aging. FASEB J 2010; 24: 3562–71. CrossRef MEDLINE
e3.
Dhingra R, et al.: Relations of serum phosphorus levels to echocardiographic left ventricular mass and incidence of heart failure in the community. Eur J Heart Fail 2010; 12: 812–8. MEDLINE
e4.
Prie D, Urena Torres P, Friedlander G: Latest findings in phosphate homeostasis. Kidney Int 2009; 75: 882–9. MEDLINE
e5.
Martin KJ, Gonzalez EA: Prevention and control of phosphate retention/hyperphosphatemia in CKD-MBD: what is normal, when to start, and how to treat? Clin J Am Soc Nephrol 2011; 6: 440–6. CrossRef MEDLINE
e6.
Stubbs JR, et al.: Role of hyperphosphatemia and 1,25-dihydroxyvitamin D in vascular calcification and mortality in fibroblastic growth factor 23 null mice. J Am Soc Nephrol 2007; 18: 2116–24. MEDLINE
e7.
Moe SM, et al.: Medial artery calcification in ESRD patients is associated with deposition of bone matrix proteins. Kidney Int 2002; 61: 638–47. MEDLINE
e8.
Kayne LH, et al.: Analysis of segmental phosphate absorption in intact rats. A compartmental analysis approach. J Clin Invest 1993; 91: 915–22. MEDLINE
e9.
Calvo MS, Park YK: Changing phosphorus content of the U.S. diet: potential for adverse effects on bone. J Nutr 1996; 126(4 Suppl): 1168S–80S. MEDLINE
e10.
Alfrey AC: The role of abnormal phosphorus metabolism in the progression of chronic kidney disease and metastatic calcification. Kidney Int Suppl 2004: S13–7. MEDLINE





