La edad a la que la mujer entra en la menopausia no solo es decisiva para la planificación individual del niño, sino que también tiene numerosas consecuencias para la salud. Los investigadores han identificado 290 variantes genéticas que influyen en la edad al inicio de la menopausia. Estos incluyen principalmente genes que participan en la reparación de daños en el ADN. Si los investigadores manipularon algunos de estos genes en ratones, pudieron extender su vida reproductiva.
Durante los últimos 150 años, la esperanza de vida humana promedio ha aumentado significativamente y actualmente es de alrededor de 85 años. Por el contrario, la edad a la que las mujeres entran en la menopausia se ha mantenido prácticamente constante. En promedio, las mujeres entre 47 y 52 años experimentan su último período, pero también hay mujeres que pasan por la menopausia antes de los 45 años. La edad de inicio de la menopausia está influenciada por un lado por factores del estilo de vida como la dieta y el tabaquismo, y por otro lado por la predisposición genética.
Los genes de reparación del ADN afectan la menopausia
Un equipo dirigido por Katherine Ruth de la Universidad de Exeter en Gran Bretaña ahora ha analizado datos genómicos de más de 200.000 mujeres que comenzaron la menopausia entre las edades de 40 y 60. Ruth y sus colegas examinaron qué variantes genéticas influyen en la edad al inicio de la menopausia. Identificaron 290 variantes que están asociadas con un inicio más temprano o tardío de la menopausia. Hasta ahora, sólo se conocían 56 segmentos de genes de este tipo. Según los análisis, la influencia de las variantes genéticas individuales en el momento de la menopausia es de entre 3,5 semanas y 1,5 años.
"Las ubicaciones de genes identificadas están involucradas en una amplia gama de procesos relacionados con el daño del ADN", informan los investigadores. Entre otras cosas, estos genes aseguran que el ADN dañado sea reconocido y reparado o que las células con ADN dañado mueran. En los ovarios, están activos durante toda la vida de la mujer. La coautora Eva Hoffmann de la Universidad de Copenhague explica: “Está claro que reparar el ADN dañado en los óvulos es muy importante para determinar el suministro de óvulos con el que nacen las mujeres y la rapidez con la que se pierde el progreso de la vida. Una mejor comprensión de los procesos biológicos involucrados en el envejecimiento reproductivo podría conducir a mejores opciones de tratamiento de fertilidad ".
Se prolonga la vida reproductiva en ratones
En ratones, los investigadores probaron el efecto de dos genes clave, CHEK1 y CHEK2, sobre la menopausia. Ambos genes están involucrados en la respuesta al daño del ADN, siendo CHEK1 el principal responsable de reparar las áreas dañadas, mientras que CHEK2 provoca la muerte de las células con ADN defectuoso. Usando manipulación genética, los investigadores apagaron CHEK2 en ratones hembra. "En estas hembras, la reserva de óvulos se agotó más lentamente, lo que conduce a una mejor función ovárica a una edad avanzada", escriben los autores. A diferencia de los humanos, los ratones no tienen menopausia, pero la función ovárica de los animales ancianos les dio a los investigadores una indicación de que CHEK2 aparentemente hace que los óvulos mueran en condiciones normales, contribuyendo así a un inicio más temprano de la menopausia.
anuncio publicitario
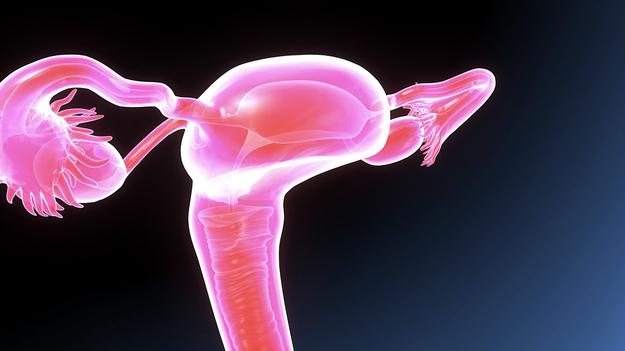
Los ratones sin CHEK1 murieron antes de nacer porque las funciones que realiza este gen son vitales. Por lo tanto, los investigadores examinaron los efectos de CHEK1 en ratones que tenían una copia adicional del gen. El resultado: "Las hembras con más proteína CHEK1 nacen con más óvulos y tardan más en vaciarse de forma natural, por lo que el tiempo de reproducción se alarga", informa el coautor Ignasi Roig de la Universidad Autónoma de Barcelona.
Sopesando el beneficio y el riesgo
Además, los investigadores examinaron la relación entre una menopausia particularmente temprana o tardía y ciertas enfermedades. Al hacerlo, encontraron, de acuerdo con estudios previos, que el inicio tardío de la menopausia se asocia con una mejor salud ósea y un menor riesgo de diabetes tipo 2. Por otro lado, los cánceres como el de mama y de ovario son más comunes en mujeres que llegan más tarde a la menopausia.
Entonces, desde el punto de vista de la salud, ¿podría tener sentido retrasar terapéuticamente la menopausia? "Lo atractiva que sea esta opción se centrará en sopesar los beneficios y los riesgos, como es el caso de la terapia de reemplazo hormonal en la actualidad", escribe Krina Zondervan de la Universidad de Oxford en un artículo que acompaña al estudio, que también se publicó en la revista Nature.
¿Asesoramiento sobre planificación familiar?
Ruth y sus colegas esperan que los resultados inspiren estudios futuros que podrían conducir a nuevas terapias para mejorar la capacidad reproductiva y mantener la fertilidad. Desde su punto de vista, sería concebible, por ejemplo, aumentar las posibilidades de éxito de las inseminaciones artificiales previniendo temporalmente la muerte de los óvulos causada por CHEK2. "Sin embargo, los tratamientos que reducen la expresión de CHEK2 podrían tener efectos adversos porque CHEK2 es un gen supresor de tumores y ciertas mutaciones de CHEK2 aumentan el riesgo de varios cánceres", dice Zondervan.
Las variantes genéticas identificadas también pueden ser útiles para aconsejar a las mujeres que desean tener hijos. "Esperamos que nuestro trabajo ayude a crear nuevas oportunidades para que las mujeres planifiquen el futuro", dice Ruth. “Al encontrar muchas otras causas genéticas para los diferentes momentos de la menopausia, podemos predecir qué mujeres entrarán en la menopausia particularmente temprano”. Sin embargo, dado que muchos otros factores juegan un papel además de los genes, el poder de predicción es limitado. Sin embargo, esta información podría respaldar la planificación familiar para las mujeres que son genéticamente propensas a un inicio de la menopausia particularmente temprano.
Fuente: Katherine Ruth (Universidad de Exeter, Reino Unido) et al., Nature, doi: 10.1038 / s41586-021-03779-7