La noción de que el microbioma puede contribuir a la patología de las enfermedades del sistema nervioso central (SNC) es compartida por informes recientes [Sharon et al., 2016]. Varios estudios muestran que un cambio en las bacterias intestinales con enfermedades neurodegenerativas como la enfermedad de Alzheimer (EA) [Mezö et al., 2020; Minter et al., 2016; Vogt et al., 2017], enfermedad de Parkinson (EP) [Keshavarzian et al., 2015; Scheperjans et al., 2015] y otras enfermedades neurológicas como la esclerosis múltiple [Berer et al., 2011] y los trastornos del espectro autista [Tabouy et al., 2018]. La microglía, los macrófagos tisulares residentes en el SNC que pertenecen al sistema inmunológico innato, podrían convertirse en mediadores celulares entre el intestino y el cerebro. En casi todas las enfermedades que afectan al cerebro, la microglía está involucrada en la patogénesis, aunque los mecanismos moleculares que controlan la actividad y funciones de la microglía en la homeostasis y en el estado patológico solo se comprenden parcialmente hasta el día de hoy.
A la contribución a la formación
El grupo de trabajo en torno al ganador del Premio Leibniz de este año, el Prof.Dr. Marco Prinz (Neuropatología de Friburgo) se ha preocupado durante mucho tiempo por la cuestión de si el microbioma intestinal influye en la microglía del sistema nervioso central. En este contexto, quedó claro que enfermedades neurodegenerativas como el Parkinson o el Alzheimer pueden estar directamente relacionadas con trastornos del microbioma intestinal. Los microorganismos que se encuentran en la cavidad bucal también parecen jugar un papel aquí. Esta contribución de formación avanzada, que no se ocupa del microbioma de la cavidad bucal, tiene como objetivo mostrar cómo los futuros proyectos de investigación en odontología pueden estar vinculados a problemas médicos generales. En comparación con el microbioma intestinal, los microorganismos de la cavidad bucal son fácilmente accesibles y posiblemente también más fáciles de influir. Dr. Elmar Hellwig, Clínica de Odontología y Periodoncia, Centro Médico de la Universidad de Friburgo
Hasta ahora se ha asumido que el cerebro tiene privilegios inmunológicos debido a sus propiedades anatómicas y fisiológicas y está protegido en gran medida de las influencias externas. En 2015, se demostró la influencia previamente desconocida de la microbiota del huésped en la maduración y función de la microglía en el SNC [Erny et al., 2015]. La microglía de ratones libres de gérmenes (GF) sin bacterias intestinales mostró una morfología, número de células, expresión génica y respuesta inmune alterados en comparación con los ratones con bacterias intestinales. Los ácidos grasos de cadena corta (AGCC), que son sintetizados por las bacterias intestinales durante la fermentación de la fibra dietética, han sido identificados como las moléculas bacterianas responsables de la maduración y función de la microglía [Erny et al., 2015].
Sin embargo, son esenciales más estudios científicos y clínicos básicos para comprender mejor la conexión entre las bacterias intestinales y las enfermedades del SNC y para desarrollar nuevos enfoques terapéuticos adecuados.
Enfermedad de Alzheimer
La enfermedad de Alzheimer (EA) recibió su nombre del psiquiatra y neuropatólogo alemán Alois Alzheimer, quien fue el primero en describir la demencia en el paciente fallecido Auguste Deter en 1906 [Holtzman et al., 2011]. Con 40 a 50 millones de personas afectadas en todo el mundo, la EA es la enfermedad neurodegenerativa más común y la causa de demencia, y las mujeres la padecen con más frecuencia que los hombres [Nichols et al., 2019]. La edad es un factor de riesgo importante para desarrollar EA, pero también influyen los factores genéticos. La forma familiar hereditaria solo representa menos del cinco por ciento de todos los casos, y la enfermedad generalmente ocurre mucho antes de los 60 años [Bertram y Tanzi, 2012]. A pesar de la investigación intensiva, todavía no existen opciones de tratamiento prometedoras. Histomorfológicamente características son la acumulación de proteína tau hiperfosforilada y el depósito extracelular de péptidos beta-amiloides (Aβ), que son causados por la escisión enzimática patológica de la proteína precursora amiloide, APP) y se acumulan en el cerebro como las denominadas placas Aβ (Figura 1) [Iqbal et al., 2005; Selkoe y Hardy, 2016]. La deposición cerebral temprana de Aβ comienza décadas antes de que aparezcan los primeros síntomas clínicos [Sperling et al., 2014] e impulsa el desarrollo y la progresión de la EA [Thériault et al., 2015]. Los depósitos de Aβ activan la microglía, que intenta descomponer los depósitos de Aβ (Figura 1). Esto desencadena una reacción inmune en la que se forman moléculas proinflamatorias y neurotóxicas, que en el curso posterior de la enfermedad conducen a la pérdida de sinapsis y la degeneración de neuronas. Como resultado, esta enfermedad neurodegenerativa se caracteriza sintomáticamente por la pérdida progresiva de la memoria y el deterioro de las funciones cognitivas [Selkoe y Hardy, 2016]. Además de los factores de riesgo genéticos, existen indicios de que las bacterias intestinales también podrían desempeñar un papel decisivo en la progresión de la EA [Harach et al., 2017; Mezö et al., 2020; Minter et al., 2016]. Estudios recientes en pacientes con EA han puesto de relieve una correlación entre los depósitos de Aβ, las citocinas proinflamatorias en la sangre y ciertas bacterias intestinales en pacientes con deterioro cognitivo [Cattaneo et al., 2017]. Un análisis adicional de las muestras de heces de pacientes con EA en comparación con las de los pacientes de control sanos mostró una diversidad microbiana reducida [Vogt et al., 2017]. En el contexto de estudios en modelos de ratones transgénicos con EA, la composición microbiana de las muestras de heces tomadas indicó una menor diversidad en comparación con los ratones de control sanos, lo que puede tener un impacto en los depósitos de Aβ en el cerebro [Harach et al., 2017; Minter et al., 2016]. Por el contrario, dos estudios actuales no pudieron confirmar ningún cambio sólido en la diversidad microbiana [Mezö et al., 2020; Parikh et al., 2020]. Para poder investigar con más detalle la influencia de la flora intestinal en los depósitos de Aβ y la progresión de la EA, se realizaron estudios en ratones transgénicos con Alzheimer que fueron criados en condiciones GF (asépticas). o cuyas bacterias intestinales se redujeron mediante la administración de antibióticos (ABX) [Harach et al., 2017; Mezö et al., 2020; Minter et al., 2016]. Tanto los ratones AD criados asépticamente como los tratados con ABX tenían menos depósitos de Aβ que los animales de control transgénicos con un microbioma intestinal, tanto en la etapa temprana de la enfermedad como en la etapa avanzada [Colombo et al., 2020; Harach y col., 2017; Mezö et al., 2020; Minter et al., 2016]. Como resultado, los animales con EA tratados con GF y ABX mostraron un comportamiento de aprendizaje mejorado y funciones de memoria mejoradas [Mezö et al., 2020]. Además, se encontró una concentración reducida de SCFA en el plasma sanguíneo de ratones AD [Colombo et al., 2020]. Después de la administración de SCFA, los ratones GF-AD mostraron una mayor deposición de Aβ, lo que sugiere que SCFA empeora el curso de la enfermedad en modelos animales [Colombo et al., 2020]. Pero, ¿qué es exactamente responsable de la progresión más rápida de la enfermedad de EA por parte de las bacterias intestinales? La microglía puede reconocer oligómeros Aβ solubles a través de receptores de superficie celular como los TLR ("receptor tipo Toll"), que conduce a la activación de la microglía. La microglía intenta descomponer y contener los depósitos de Aβ por fagocitosis (Figura 1). Sin embargo, la activación sostenida de la microglía y la exposición a citocinas y quimiocinas proinflamatorias neurotóxicas conduce a la degeneración de las neuronas con el tiempo, lo que es crucial para la progresión de la enfermedad [Heneka et al., 2015]. Se ha demostrado en ratones GF-AD que Microglia tiene una mayor actividad fagocítica de Aβ y, por lo tanto, juega un papel decisivo en la reducción de los depósitos de Aβ [Mezö et al., 2020]. Como resultado, la microglía de ratones GF-AD mostró un aumento de la expresión de genes relacionados con la fagocitosis, como Trem2 (receptor de activación expresado en células mieloides 2), Tyrobp (proteína de unión a proteína tirosina quinasa TYRO), C1qb (componente del complemento 1q) y apoe (apolipoproteína E) [Mezö et al., 2020] En general, estos resultados sugieren que las bacterias intestinales tienen un efecto negativo en la patología de la EA, y que la eliminación de los depósitos de Aβ se ve afectada por la microglía (Figura 2). Sin embargo, es esencial realizar más estudios científicos y clínicos básicos para comprender mejor la relación entre la microbiota y la EA y permitir posibles opciones terapéuticas futuras.
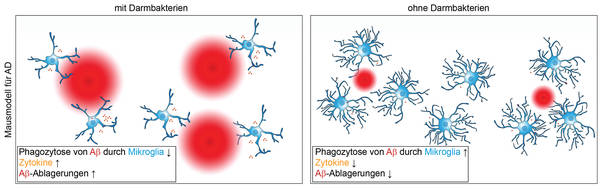
Fig. 2: Influencia de las bacterias intestinales en la microglía durante la enfermedad de Alzheimer en un modelo animal: la microglía (azul) fagocita los depósitos de Aβ (rojo). | Mezo, príncipe, Erny
enfermedad de Parkinson
La enfermedad de Parkinson (EP) es un trastorno progresivo del movimiento caracterizado por rigidez, temblor, bradicinesia, pero también por síntomas no motores como molestias intestinales y estreñimiento crónico [O'Sullivan et al., 2008]. A nivel histopatológico, la EP está asociada a la acumulación de agregados de α-sinucleína (α-syn), los denominados cuerpos de Lewy. En el transcurso de esto, se produce una degeneración que progresa lentamente de las neuronas dopaminérgicas en la sustancia negra del mesencéfalo [Dickson, 2018; Shulman y col., 2011]. Casi el 80 por ciento de los pacientes con EP tienen anomalías gastrointestinales, que incluyen alteración de la motilidad gástrica, sobrecrecimiento bacteriano del intestino delgado e infecciones por Heliobacter pylori [Fasano et al., 2015; Scheperjans et al., 2015]. Se especula que los agregados de α-syn se acumulan primero en el área del ciego, luego llegan al cerebro a través del sistema nervioso entérico a través del nervio vago y, por lo tanto, se diseminan como "priones" en casos esporádicos [Braak et al., 2004]. Esta suposición está respaldada por el hecho de que los agregados de α-syn ya están presentes temprano en el intestino, en las neuronas entéricas y en el nervio vago, antes incluso de que puedan detectarse en el sistema nervioso central [Bencsik et al., 2014; Braak y col., 2004]. Además, se observó una permeabilidad intestinal anormal, que podría promover la propagación de α-Syn en el SNC [Forsythe et al., 2014]. En un modelo animal, Holmqvist y sus colegas demostraron que la inyección de α-Syn fibrilar en el tejido intestinal de ratas sanas es suficiente para desencadenar una patología en el nervio vago y el tronco encefálico [Holmqvist et al., 2014]. Además, una vagotomía completa mostró una progresión moderada de la enfermedad, lo que sugiere la participación del nervio vago como un canal para la diseminación de α-syn desde el sistema entérico al SNC [Svensson et al., 2015]. Por otro lado, la estimulación eléctrica del nervio vago y su potencial efecto antiinflamatorio en el cerebro de ratones que recibieron lipopolisacáridos bacterianos (LPS) para inducir una respuesta inflamatoria [Meneses et al., 2016]. En consecuencia, después de la estimulación eléctrica, hubo una producción reducida de citocinas proinflamatorias, como la interleucina-6 (IL-6) y el factor de necrosis tumoral alfa (TNFα), por microglia en el cerebro. Esta respuesta no ocurrió en ratones vagotomizados. Estos estudios apoyan la suposición de que α-Syn ingresa al cerebro a través del nervio vago y activa la microglía. Sin embargo, la noción de que la agregación comienza en el sistema nervioso entérico y se disemina al SNC sigue siendo controvertida [Burke et al., 2008], por lo que se necesitan más estudios para comprender mejor la influencia de las bacterias intestinales en la EP. En lo que respecta a la composición microbiana, los análisis de muestras de heces de pacientes con EP mostraron una composición microbiana alterada en comparación con voluntarios sanos, lo que se correlacionó con el fenotipo clínico de la enfermedad [Keshavarzian et al., 2015; Scheperjans et al., 2015]. Un subgrupo de pacientes con EP mostró una mayor incidencia de Enterobacteriaceae y una reducción de Bacteroidetes y Prevotellaceae, que se asoció con la gravedad de los síntomas motores. Unger y sus colegas descubrieron niveles alterados de AGCC en las heces de los pacientes de Parkinson, lo que sugiere que los metabolitos microbianos pueden desempeñar un papel en el mantenimiento de una buena salud [Unger et al., 2016]. Este hallazgo también se confirmó en el modelo de ratón transgénico de Parkinson [Sampson et al., 2016]. Los animales mantenidos convencionalmente mostraron, junto con la disfunción motora, un alto grado de agregación de α-syn en el cerebro, mientras que se observaron significativamente menos agregaciones de α-syn y déficits motores en los animales GF. La administración de AGCC intensificó drásticamente los síntomas Como se describió anteriormente en el contexto de la EA, la acumulación de α-Syn en la EP también conduce a la activación de la microglía [Kim et al., 2013; Sánchez-Guajardo et al., 2013], lo que conduce a una mayor expresión de TNFα e IL-6 en microglia [Sampson et al., 2016]. La activación de la microglía en ratones PD transgénicos GF se debilitó significativamente y podría incrementarse nuevamente mediante la administración de SCFA (Figura 3). La activación de la microglía se correlacionó con la extensión de los depósitos de α-syn y el deterioro motor correspondiente.
Fig.3: Influencia de las bacterias intestinales en la microglía durante la enfermedad de Parkinson en un modelo animal: las microglías (azul) son activadas por depósitos de alfa-sinucleína (rojo) y secretan citocinas neurotóxicas como el factor de necrosis tumoral alfa (TNFα) y la interleucina (IL) 6 (naranja). | Mezo, príncipe, Erny
En la actualidad se puede suponer que las bacterias intestinales influyen en la activación inmunitaria dependiente de α-Syn de la microglía, pero la medida en que las bacterias intestinales desencadenan o incluso impulsan la patología de la EP aún no se explica en gran medida y se está investigando en estudios actuales.
Charlotte Mezö, M.Sc.
| hospital universitario de Friburgo
desde 2017: Doctorado en biología en el Instituto de Neuropatología, Centro Médico Universitario de Friburgo
2014-2017: curso de maestría en neurobiología, Universidad Eberhard-Karls de Tübingen
2011-2014: Estudios de biología (Licenciatura en artes), Universidad Eberhard-Karls de Tübingen
Prof. Dr. medicina Marco Prince
| hospital universitario de Friburgo
1990-1996: estudios de medicina en la Universidad Humboldt de Berlín (Charitè)
1997: Disertación en medicina humana, Universidad Humboldt de Berlín (Charitè)
1997–1998: Postdoctorado, Neurociencia Celular, Max Delbrück Center (MDC), Berlín
1999-2000: Postdoctorado, Instituto de Neuropatología, Hospital Universitario de Zúrich
2001-2002: Postdoctorado sénior, Instituto de Neuropatología, Hospital Universitario de Zúrich
2002-2008: Líder de grupo y, desde 2004, médico senior, Instituto de Neuropatología, Universidad Georg-August, Göttingen
2004: Habilitación en neuropatología, Universidad Georg August, Gotinga
desde 2008: Director médico (W3), Instituto de Neuropatología, Hospital Universitario de Friburgo
Prinz fue el coordinador de importantes proyectos científicos y conferencias, por ejemplo en DFG-SFB / TR1667 "NeuroMac" (portavoz), grupo de investigación DFG FOR 1336 "Macrófagos cerebrales" (co-portavoz), conferencia Keystone "Microglia", Keystone, EE. UU. (organizador). Trabaja como revisor de revistas especializadas como Cell, Immunity, Nature, Nat Neurosci, Science.